Stimulation magnétique transcrânienne répétitive
Dissocie la manipulation de la mémoire de travail
des fonctions de rétention dans le préfrontal,
mais pas pariétal postérieur, Cortex
Bradley R.. Postle, Fabio Ferrari, Massihullah Hamidi,
Eva Feredoès, Marcello Massimini, Michael Peterson,
André Alexandre, et Giulio Tononi
D
o
w
n
je
o
un
d
e
d
F
r
o
m
je
je
/
/
/
/
/
j
F
/
t
t
je
t
.
:
/
/
D
h
t
o
t
w
p
n
:
o
/
un
/
d
m
e
je
d
t
F
p
r
o
r
m
c
.
h
s
je
p
je
v
d
e
je
r
r
e
c
c
h
t
.
un
m
je
r
e
.
d
c
u
o
m
o
/
c
j
n
o
un
c
r
n
t
je
c
/
un
e
r
–
p
t
d
je
c
1
je
8
e
1
–
0
p
1
d
7
F
1
/
2
1
8
1
/
9
1
3
5
0
6
/
0
1
3
7
1
o
2
c
/
n
1
2
7
0
5
0
5
6
9
1
4
8
8
/
1
j
0
o
1
c
7
n
1
.
2
2
p
0
d
0
6
b
.
oui
1
g
8
u
.
e
1
s
0
t
.
o
1
n
7
0
1
7
2
S
.
e
p
p
d
F
e
m
b
b
oui
e
r
g
2
u
0
e
2
s
3
t
/
j
t
.
.
F
.
.
.
o
n
1
8
M.
un
oui
2
0
2
1
Abstrait
& Comprendre les apports du cortex préfrontal
(PFC) la mémoire de travail est essentielle pour comprendre le nouveau-
bases réelles de la cognition de haut niveau. Une question qui reste
controversé est de savoir si les mêmes zones du PFC dorsolatéral
(dlPFC) qui participent à la manipulation de l'information dans
la mémoire de travail contribue également à sa rétention à court terme
(STR). Nous avons évalué cette question en identifiant d'abord, avec
imagerie par résonance magnétique fonctionnelle (IRMf), zones du cerveau
impliqué dans des manipulations. Suivant, ces zones ont été ciblées avec
stimulation magnétique transcrânienne répétitive (SMTr) pendant que je suis sous-
les projets ont effectué des tâches nécessitant uniquement le STR ou le STR
plus manipulation des informations dans la mémoire de travail. IRMf
a indiqué que l’activité liée à la manipulation était indépendante
d'activité liée à la rétention dans le PFC et le supérieur
pariétal
lobule (SPL). SMTr, cependant, a donné un résultat différent
modèle de résultats. Bien que la SMTr du dlPFC soit sélectivement
manipulation perturbée, rTMS du SPL a perturbé le manipu-
lation et STR dans la même mesure. rTMS du postcentral
gyrus (une région de contrôle) n'a eu aucun effet sur les performances. Le
les implications de ces résultats sont doubles. Au PFC, ils sont
cohérent avec l’idée selon laquelle cette région contribue davantage
important pour le contrôle des informations dans la mémoire de travail
qu'à son STR. Dans la SPL, ils illustrent l'importance
de compléter les données fondamentalement corrélationnelles de
neuroimagerie avec une méthode disruptive, ce qui offre une forte-
inférence Ger sur les relations structure-fonction. &
INTRODUCTION
Une perspective sur le rôle du cortex préfrontal (PFC)
c'est qu'il prend en charge la rétention à court terme (STR, alternativement
appelé « stockage » ou « maintenance ») les fonctions (par exemple.,
Courtney, 2004; Leung, Béni, & Sang, 2004; Homme d'or-
Rakić & Leung, 2002; Personne, Gutiérrez, Bandettini, &
Ungerleider, 2002; Constantinide, Franowicz, & Homme d'or-
Rakić, 2001; Funahashi, Frottement, & Goldman-Rakic, 1993),
et peut donc être considéré comme supportant les tampons de
un système de mémoire de travail à composants multiples tel que
celui proposé par Baddeley (2000) et Baddeley et Logie
(1999). Une perspective alternative nie un rôle important
en STR pour le PFC (par exemple., Lébédev, Messinger, Kralik, &
Sage, 2004; Pétrides, 2000; D'Esposito & Postle, 1999),
attribuant ces fonctions à l'activité dans le non-
Régions PFC qui ont évolué pour accomplir des fonctions sensorielles.,
représentation-, et fonctions liées à l'action (par exemple., Postle,
2006; En Ionie, Lacé, & Née, 2005; Pasternak & Greenlee,
2005; Théeuwes, Olivier, & Chizk, 2005). On implique-
Ce dernier point de vue est que la mémoire de travail peut être
Université du Wisconsin
mieux compris comme une propriété émergente de l'esprit
et le cerveau, plutôt que comme un système qui peut être facilement
localisé (Un scanner, par exemple., vision vers le cortex occipital ou
contrôle squelettique du gyrus précentral).
Une façon d’opérationnaliser la rétention de la mémoire de travail
processus consiste à faire varier le nombre d'éléments qui doivent
être retenus sur différents essais - régions du cerveau dont
l’activité en période de retard est sensible à de telles variations
la charge de mémoire est présumée contribuer à la rétention-
processus associés. À ce jour, le re magnétique fonctionnel-
imagerie sonore (IRMf) littérature sur la sensibilité à la charge
du PFC dorsolatéral (dlPFC) activité de période de retard
car les stimuli verbaux ont été mélangés, avec quelques études
trouver des preuves pour (Narayanan et coll., 2005; Particules,
j'ai racké, Abela, Flynn, & Arrière, 2005; Veltman, Rombouts,
& Dolan, 2003), et certains trouvent des preuves contre
(Férédoes & Postle, 2005; Postle, Berger, & D'Esposito,
1999; Rypma & D'Esposito, 1999). La même étude de
Postle et coll.. (1999) a également signalé des preuves selon lesquelles certains
les régions insensibles à la charge du dlPFC étaient néanmoins
sensible à l'obligation de réorganiser le contenu
de mémoire de travail pendant la période de retard - un opérateur-
à son tour,
nationalisation de la manipulation. Ces résultats,
D 2006 Massachusetts Institute of Technology
Journal des neurosciences cognitives 18:10, pp. 1712–1722
ont été contestés par Veltman et al. (2003), OMS
a signalé que la « maintenance » (ce à quoi nous faisons référence dans ce
article comme rétention) et la manipulation « s’activent virtuellement »
systèmes identiques’’ (p. 247). Clairement, la neuroimagerie
la littérature relative à cette question est dans une impasse.
La présente étude visait à aborder la question spécifique-
question cruciale de savoir si STR et la manipulation fonctionnent-
colocaliser dans le dlPFC et de le faire avec une méthode
cela soutiendrait une inférence plus forte que ne l'auraient fait les
études de neuroimagerie réalisées à ce jour. Cette approche
impliquait de compléter l'IRMf par des examens transcrâniens répétitifs
stimulation magnétique (SMTr), une méthode qui produit
la perturbation temporaire du fonctionnement d'un organisme local-
région du cortex. Bien que les données IRMf soient limitées aux tests
hypothèses sur les corrélations cerveau-comportement, La SMTr peut
répondre aux hypothèses sur la nécessité d'une zone cérébrale
à un aspect particulier de la performance cognitive ( Walsh
& Pascual-Leone, 2003). Un objectif supplémentaire de cette étude
était d'élargir l'enquête sur la manipulation dans
mémoire de travail au-delà du PFC, pour refléter le général
consensus selon lequel la plupart des exemples de cognition de haut niveau, dans-
y compris le contrôle de la mémoire de travail, sont pris en charge
par des réseaux largement distribués qui s'étendent au-delà de ce
une région du cerveau. Notre procédure en deux étapes impliquait d'abord,
acquérir des données IRMf alors que les sujets effectuaient un retard
reconnaissance avec différentes charges et différentes manipulations-
Exigences de régulation, et deuxieme, délivrer la SMTr à
Zones identifiées par IRMf du dlPFC et du pariétal supérieur
lobule (SPL) avec rTMS tandis que les mêmes sujets par-
formé la même tâche. (Le SPL a également été impliqué
en contrôle exécutif, par exemple., Garavan, Ross, Li, & Stein, 2000,
et a montré une activité liée à la manipulation dans le passé
études, observation inédite). Nous avions prédit que
rTMS à période de retard des régions sensibles à la manipulation de
le dlPFC et le SPL produiraient des déficits sélectifs sur
essais nécessitant la manipulation, mais pas le simple re-
tension, d'éléments en mémoire de travail.
MÉTHODES
Sujets
Le 12 adultes (6 les hommes et 6 femmes; âge moyen = 22 années,
SD = 2.7) dont les données sont présentées ici n'avaient pas de psy-
troubles chiatriques ou neurologiques, tel que déterminé par le physique-
examen ique, un diagnostic psychiatrique structuré
entretien de sélection (Mini-International Neuropsychiatrique
Entretien; Sheehan et coll., 1998), et une évaluation de l'humeur
(Échelle d'évaluation de la dépression de Hamilton; Hamilton, 1960), tous
administré par un psychiatre.
Tâche comportementale
La tâche, exigeant une reconnaissance retardée de la position de l'article,
était identique à celui utilisé par Postle et al.. (1999). Chaque
le procès a commencé par la présentation simultanée de deux ou
cinq lettres de consonnes (le tout sur une seule rangée), suivi de
instructions (« avancer » ou « classer par ordre alphabétique »), suivi de
un délai de 8 secondes, suivi d'une sonde mémoire
comprenant un élément de l'ensemble de mémoire et un chiffre.
Sur les essais avancés, les sujets devaient conserver un souvenir de
les deux ou cinq lettres dans l'ordre dans lequel elles ont été
présenté. Sur ces essais, le chiffre de la sonde représenté
(avec p = .5) la position ordinale dans laquelle le sondé
la lettre était apparue dans l'affichage initial du stimulus. Sur
alphabétiser les essais, les sujets devaient réorganiser les lettres
par ordre alphabétique. Sur ces essais, le chiffre de la sonde
représentée (aussi avec p = .5) la position alphabétique
de la lettre sondée par rapport aux quatre autres lettres
dans le jeu de mémoire.
D
o
w
n
je
o
un
d
e
d
F
r
o
m
je
je
/
/
/
/
/
j
F
/
t
t
je
t
.
:
/
/
D
h
t
o
t
w
p
n
:
o
/
un
/
d
m
e
je
d
t
F
p
r
o
r
m
c
.
h
s
je
p
je
v
d
e
je
r
r
e
c
c
h
t
.
un
m
je
r
e
.
d
c
u
o
m
o
/
c
j
n
o
un
c
r
n
t
je
c
/
un
e
r
–
p
t
d
je
c
1
je
8
e
1
–
0
p
1
d
7
F
1
/
2
1
8
1
/
9
1
3
5
0
6
/
0
1
3
7
1
o
2
c
/
n
1
2
7
0
5
0
5
6
9
1
4
8
8
/
1
j
0
o
1
c
7
n
1
.
2
2
p
0
d
0
6
b
.
oui
1
g
8
u
.
e
1
s
0
t
.
o
1
n
7
0
1
7
2
S
.
e
p
p
d
F
e
m
b
b
oui
e
r
g
2
u
0
e
2
s
3
t
/
j
t
.
F
.
.
.
.
o
n
1
8
M.
un
oui
2
0
2
1
Imagerie par résonance magnétique fonctionnelle
Acquisition et prétraitement des données
Des images du cerveau entier ont été acquises avec un scanner 3-T (GE
Signa VH/I, Waukesha, WI). Haute résolution pondérée T1
images (30 tranches axiales, 0.9375 (cid:1) 0.9375 (cid:1) 4 mm) étaient ob-
retenu chez tous les participants, et un écho de dégradé, échoplanaire
séquence (TR = 2000 msec, LE = 50 msec) avait l'habitude de
acquérir des données sensibles au niveau d'oxygène dans le sang-
bosse (AUDACIEUX) signal (Kwong et al., 1992; Ogawa et coll.,
1992) dans un 64 (cid:1) 64 matrice (30 tranches axiales coplanaires
avec l'acquisition T1, 3.75 (cid:1) 3.75 (cid:1) 4 mm, pas de saut).
Les analyses de la tâche de reconnaissance différée ont été précédées par
un scan dans lequel nous avons dérivé une estimation de l'hémodie-
fonction de réponse nominative (FRH) pour chaque participant.
Durant cette analyse, chaque participant a effectué une simple
tâche de temps de réaction nécessitant une pression bimanuelle sur un bouton
une fois tous les 20 sec en réponse à un bref changement de forme
du stimulus de fixation. Un test F partiel associé à un
Ensemble de covariables de base de Fourier ( Joseph, Tourneur, & Friston,
1997) a été utilisé pour évaluer l’importance de la tâche-
activité corrélée dans chaque voxel du système somatosensoriel primaire
et régions corticales motrices d'intérêt (ROI). Le FRH
l'estimation a été extraite des voxels supra-seuil
de ces ROI en faisant la moyenne spatiale de leurs séries temporelles, fil-
en triant la série chronologique IRMf moyenne résultante pour supprimer
haut (> 0.244 Hz) et faible (< 0.05 Hz) frequencies,
adjusting it to remove the effects of nuisance covari-
ates (Friston, Holmes, Poline, Heather, & Frackowiak,
1995), and trial averaging. The HRF characterizes the
fMRI response resulting from a brief impulse of neural
activity (Boynton, Engel, Glover, & Heeger, 1996) and can
vary markedly across subjects (Handwerker, Ollinger, &
D’Esposito, 2004; Aguirre, Zarahn, & D’Esposito, 1998).
The subject-specific HRFs were used to convolve inde-
pendent variables entered into the modified general
linear model (GLM; Worsley & Friston, 1995) that we
used to analyze the data from the scans of the working
memory task. The eight scans of the working memory
task each lasted 6 min 20 sec (6 min of task preceded by
20 sec of dummy pulses to achieve a steady state of tissue
magnetization).
Postle et al.
1713
Analyses
The fMRI time series analysis modeled the signal change
associated with each discrete epoch of the trial with a
covariate comprised of a BOLD HRF shifted along the
timeline of the task in order best model the trial epoch
in question (Postle, Zarahn, & D’Esposito, 2000; Zarahn,
Aguirre, & D’Esposito, 1997). The least-squares solu-
tion of the GLM of the fMRI time series data yielded
parameter estimates that were associated with each co-
variate of interest. The smoothness of the fMRI response
to neural activity allows fMRI evoked responses that
arise from temporally dependent events to be resolved
on the order of 4 sec (Zarahn et al., 1997). Load-sensitive
and alphabetization-sensitive voxels were identified
with the contrasts [DelayForward 5–DelayForward 2] and
[DelayAlphabetize 5–DelayForward 5], respectively, thresh-
olded at a mapwise level of p = .05, Bonferroni-corrected
for multiple comparisons.
Because the principal function of the fMRI data for
this study was to provide activation maps that would
guide the rTMS, the principal analyses were performed
as single-subject analyses. (This first step was a precise
replication of the procedure from Postle et al., 1999.)
Transforming a subject’s anatomical and functional data
into a ‘‘normalized’’ atlas space would not be appropri-
ate with this approach for the simple reason that rTMS
can only be applied to a subject’s brain in its ‘‘native’’
configuration (i.e., it is not possible to apply rTMS to a
composite, group-normalized statistical volume; for a
similar approach, see the work of Herwig et al., 2003).
Before the rTMS session, the whole-brain alphabetiza-
tion statistical map was coregistered and merged with a
high-resolution T1-weighted anatomical scan. The three-
dimensional reconstruction of this merged image would
be used to guide rTMS.
To provide a sense of aggregate trends in activity
produced by our task, we also performed a spatial
normalization-based group analysis. This analysis was
performed by first warping unthresholded statistical
volumes from each subject to a template in MNI space,
smoothing them to 8-mm full width half maximum, then
evaluating the reliability of these statistical maps across
subjects with a ‘‘second-level’’ analysis implemented
with a GLM that treated subject as a random variable.
The resultant group maps were thresholded at p = .01,
uncorrected for multiple comparisons.
Transcranial Magnetic Stimulation
Procedure
The behavioral task used in the rTMS session only in-
cluded Alphabetize 5 and Forward 5 trials that occurred
with equal probability in a randomly determined or-
der. An intertrial interval of 10 sec separated each trial.1
Orthogonal to the factor of instructions was that of rTMS
(present, absent; each also occurring randomly with p =
.5). An entire rTMS study comprised 12 twelve-trial
blocks, with four consecutive blocks performed for each
stimulation site: middle frontal gyrus (MFG) of the dlPFC,
SPL, and postcentral gyrus (PCG). Order of stimulation
site was counterbalanced across subjects. Within each
block, the orthogonal factors of instructions (alphabetize,
forward) and rTMS (present, absent) were randomized
such that each trial type occurred three times during each
block. Probe validity also varied independently of the two
principal factors of interest, such that an equal number of
valid and invalid probes occurred during each block, no
more than two trials of any type (e.g., an ‘‘alphabetize,
rTMS absent’’ trial) featured a valid probe within a single
block, and an equal number of valid and invalid probes
(i.e., three) had occurred for each trial type upon com-
pletion of each even-numbered block.
Apparatus
TMS was delivered with a Magstim Standard Rapid mag-
netic stimulator fit with a 70-mm figure-8 stimulating coil
(Magstim, Whitland, Wales, UK). The first step of the
TMS session was to determine the minimal intensity at
which a single pulse through the TMS coil, positioned
over the motor cortex, reliably produced a motor-evoked
potential of (cid:2)50 AV in the abductor pollicis brevis in 5
of 10 successive stimuli. This ‘‘motor threshold’’ was the
intensity at which the subsequent rTMS was performed.2
As stated in the Introduction section, the logic of
the experiment was to target portions of the dlPFC
and SPL that showed alphabetization sensitivity (i.e.,
DelayAlphabetize 5 > RetardAvant 5) dans l'IRMf. Ce
a été réalisé via co-enregistrement, avec infrarouge
stéréotaxie sans cadre (Stimulation cérébrale guidée par eXimia
[NBS]; NextStim, Helsinki, Finlande), de la tête du sujet
avec ses données IRM. La bobine TMS était également équipée de
balises réfléchissant l'infrarouge, nous permettant ainsi de tar-
obtenir des régions identifiées dans les données IRMf avec rTMS. NBS
fonctionne en partant du principe que TMS préfère
stimule les neurones situés dans la zone où l'induction
le courant est le plus fort (Thielscher & chambre, 2002). Le
Le système affiche la zone corticale susceptible d'être maximale
stimulé par TMS en affichant le champ électrique maxi-
maman dans le cortex après avoir calculé la distribution estimée-
bution et force du champ électrique intracrânien. Ce
le calcul prend en compte la forme exacte du
câblage en cuivre à l'intérieur de la bobine TMS, le tridimensionnel
position et orientation de la bobine, et la forme générale
de la tête et du cerveau.
Sélection de la cible
Dans chaque matière, un seul site a été stimulé dans chacun des
trois régions: dlPFC, SPL, et un site de contrôle au PCG.
Nous avons choisi de cibler les « hotspots » de chaque individu
les données IRMf du sujet, plutôt que des zones définies par compos-
ça, cartes statistiques moyennées par groupe, à cause de la croissance
1714
Journal des neurosciences cognitives
Volume 18, Nombre 10
D
o
w
n
je
o
un
d
e
d
F
r
o
m
je
je
/
/
/
/
/
j
F
/
t
t
je
t
.
:
/
/
D
h
t
o
t
w
p
n
:
o
/
un
/
d
m
e
je
d
t
F
p
r
o
r
m
c
.
h
s
je
p
je
v
d
e
je
r
r
e
c
c
h
t
.
un
m
je
r
e
.
d
c
u
o
m
o
/
c
j
n
o
un
c
r
n
t
je
c
/
un
e
r
–
p
t
d
je
c
1
je
8
e
1
–
0
p
1
d
7
F
1
/
2
1
8
1
/
9
1
3
5
0
6
/
0
1
3
7
1
o
2
c
/
n
1
2
7
0
5
0
5
6
9
1
4
8
8
/
1
j
0
o
1
c
7
n
1
.
2
2
p
0
d
0
6
b
.
oui
1
g
8
u
.
e
1
s
0
t
.
o
1
n
7
0
1
7
2
S
.
e
p
p
d
F
e
m
b
b
oui
e
r
g
2
u
0
e
2
s
3
t
/
j
t
F
.
.
.
.
.
o
n
1
8
M.
un
oui
2
0
2
1
preuves de niveaux élevés de topographie intersujet
variabilité dans de nombreux domaines de la cognition (par exemple., Avaler,
Plus courageux, Snyder, Speer, & Zacks, 2003; Tsao, Friwald,
Knutsen, Mandeville, & Cellule produit, 2003; Miller et al., 2002),
y compris le STR des informations (Férédoes & Postle,
2005), mais une variabilité intra-sujet relativement plus faible dans le temps
(c'est à dire., bonne fiabilité test-retest, Férédoes & Postle, 2005;
Peeling & Downing, 2005; Tsao et coll., 2003; Miller et al.,
2002). (Une manifestation d'un topographe intersujet élevé-
La variabilité classique dans le présent ensemble de données était que la moyenne
la taille de l'effet d'alphabétisation du dlPFC était un ordre
d'ampleur plus grande dans les analyses sur un seul sujet, 2% eux-mêmes-
changement final, Chiffre 1, que dans l’analyse moyenne du groupe,
0.33 % changement de signal, en moyenne sur les deux hémi-
sphères; Tableau 1.) Basé sur ceci, il se peut qu'un seul-
la carte statistique du sujet fournit une meilleure estimation de la
véritable emplacement anatomique de l'activité liée à la tâche pour cela
sujet que ne le ferait une carte dérivée d'une moyenne de groupe.
(Si nous appliquions le rTMS aux sous-marins-
sujets pour lesquels nous n'avions pas de données IRMf, cependant, notre
la meilleure estimation proviendrait des données moyennes du groupe.)
Dans certains cas, il y avait plusieurs foyers d'alpha-
activité sensible à la bétisation dans une région particulière, et en
dans ces cas, le foyer sélectionné était celui dont le stim-
ulation a été jugée par les expérimentateurs comme étant la plus
susceptible d'être toléré par le sujet. En particulier, cible-
régions du MFG situées relativement ventralement et
vers l'avant augmente la probabilité de stimuler le su-
muscle auriculaire inférieur, qui peut produire des effets involontaires
grimace et inconfort. Dans de tels cas, si un autre
les foyers de sensibilité à l’alphabétisation se situaient dans un contexte plus
partie dorsale et/ou postérieure du MFG, nous serions
cibler ce dernier objectif. En particulier, nous avons trouvé cette stimulation-
sites de ulation proches ou chevauchant la banque inférieure de
le sillon frontal supérieur était bien toléré par les sous-
projets.3 Une autre contrainte était que, pour chaque individu
sujet, les trois sites de stimulation étaient dans le même hémi-
sphère. Cela signifiait que, pour chaque sujet, l'hémi-
la sphère à stimuler était déterminée par l'emplacement
d'activité sensible à l'alphabétisation dans le dlPFC et le SPL.
PCG a été choisie comme région de contrôle pour cette étude.-
car il était présumé n'avoir aucune implication directe dans
n'importe quel composant de la tâche de mémoire de travail, Et ainsi
pourrait servir de région pour contrôler les effets non spécifiques
de la SMTr corticale. Donc, Les sites de stimulation PCG étaient
expressément sélectionné pour l'absence d'alphabetiza-
tion- ou activité sensible à la charge. À chaque site de stimulation,
la bobine stimulante était orientée avec la pointe de la poignée-
en arrière par rapport à la tête du sujet, et
à peu près parallèle à la ligne médiane, afin d'induire du courant dans
le cerveau dans la direction postéro-antérieure.
Paramètres de stimulation
Sur les essais de stimulation présente, le système a été programmé
livrer 30 impulsions également espacées pendant une période de 6 secondes,
début 2 sec après le décalage des instructions et
durable pour le reste 6 sec du délai (c'est à dire., un
6-train d'une seconde de 5 HzrTMS). Cependant, une programmation
une erreur a été détectée une fois l'expérience terminée,
et l'inspection des journaux de stimulation a indiqué que pour
trois sujets, le 30 les impulsions ont été effectivement délivrées
Chiffre 1. Charge de groupe et
effets d'alphabétisation de
les données IRMf. Les effets étaient
extrait en deux étapes
processus. D'abord, sensible à la charge
et sensible à l'alphabétisation
des voxels ont été identifiés dans chaque
des trois types de régions.
Deuxième, l'ampleur de la charge
et sensibilité à l'alphabétisation
a été déterminé pour les voxels
identifié à l'étape 1. Le
topographie de la sensibilité à la charge
varié selon les sujets
(voir le texte), et les effets
affichés ici ont été dessinés
à partir du défini fonctionnellement
région sensible à la charge de
chaque sujet. Parce que la charge
la sensibilité n’a été observée que
dans deux matières du dlPFC
(Sujets 16 et 21) et
dans deux matières du SPL
(Sujets 21 et 27), ces
les résultats sont tracés sous forme unique
points de données, plutôt que comme
moyens. Les barres d'erreur représentent
95% intervalles de confiance.
D
o
w
n
je
o
un
d
e
d
F
r
o
m
je
je
/
/
/
/
/
j
F
/
t
t
je
t
.
:
/
/
D
h
t
o
t
w
p
n
:
o
/
un
/
d
m
e
je
d
t
F
p
r
o
r
m
c
.
h
s
je
p
je
v
d
e
je
r
r
e
c
c
h
t
.
un
m
je
r
e
.
d
c
u
o
m
o
/
c
j
n
o
un
c
r
n
t
je
c
/
un
e
r
–
p
t
d
je
c
1
je
8
e
1
–
0
p
1
d
7
F
1
/
2
1
8
1
/
9
1
3
5
0
6
/
0
1
3
7
1
o
2
c
/
n
1
2
7
0
5
0
5
6
9
1
4
8
8
/
1
j
0
o
1
c
7
n
1
.
2
2
p
0
d
0
6
b
.
oui
1
g
8
u
.
e
1
s
0
t
.
o
1
n
7
0
1
7
2
S
.
e
p
p
d
F
e
m
b
b
oui
e
r
g
2
u
0
e
2
s
3
t
/
j
t
.
.
.
F
.
.
o
n
1
8
M.
un
oui
2
0
2
1
Postle et coll..
1715
Tableau 1. Tableau des activités identifiées dans les analyses de groupe basées sur la normalisation spatiale
Région d'activation
X
oui
z
Coordonnées INM (mm)
Taille de l'effet (Pourcentage moyen
Changement de signal)
Volume d'activation
(mm3)
Contraste d'alphabétisation
PFC droit
PFC gauche
Cortex cingulaire antérieur
Gyrus frontal supérieur
SPL droit
Sillon intrapariétal droit
SPL gauche
SPL gauche
Lobule pariétal inférieur gauche
31.88
26.3
(cid:3)2
7.7
3.8
33.8
(cid:3)15
(cid:3)7.5
(cid:3)37.5
Tête droite du noyau caudé
11.25
Tête gauche du noyau caudé
(cid:3)11.25
Contraste de charge
Gyrus frontal inférieur gauche/MFG
Sillon central droit
PCG droit
SPL droit
Gyrus frontal inférieur droit
Gyrus fusiforme droit
Amygdale droite
Lobe temporal médial droit
(cid:3)45
30
18.75
26.25
67.5
48.75
22.5
18.75
22.5
28.1
10.5
1.9
(cid:3)63.8
(cid:3)60
(cid:3)56.25
(cid:3)60
(cid:3)45
11.25
7.5
(cid:3)7.5
(cid:3)41.25
(cid:3)33.75
(cid:3)71.25
7.5
(cid:3)45
(cid:3)3.75
(cid:3)18.75
36
34
40
66
48
44
56
44
56
12
14
44
56
64
48
32
(cid:3)24
(cid:3)20
(cid:3)16
0.37
0.29
0.34
0.46
0.63
0.42
0.39
0.38
0.47
0.45
0.13
0.14
0.21
0.23
0.73
0.42
0.41
0.43
3825.0
2137.5
562.5
956.3
900.0
506.3
506.3
281.3
900.0
1012.5
5.6
5.6
5.6
56.3
56.3
56.3
56.3
56.3
Les coordonnées rapportées ici indiquent les centres de clusters d'activité identifiés dans chaque région anatomique. Identification des éléments anatomiques
les régions ont été confirmées via la conversion des coordonnées MNI en coordonnées Talairach avec la routine mni2tal Matlab de Matthew Brett (http://
www.mrc-cbu.cam.ac.uk/Imaging/mnispace.html) et en les recherchant dans l'atlas de Talairach et Tournoux (1988).
une époque de 6,3 secondes (donc, à un taux de 4.8 Hz), et pour
les neuf matières restantes, le 30 les légumineuses étaient livrées-
s'est déroulé sur une période de 6,8 secondes (donc, à un taux de 4.3 Hz).
Le résultat fut que, pour chaque sujet, la rTMS a été délivrée
lors de la finale 6 sec du délai et a continué
pendant les premières centaines de ms après le début de la
sonde. Ce « débordement » de rTMS dans la partie sonde
du procès, bien que malheureux, ne complique pas
notre interprétation de nos résultats, pour des raisons somme-
renseigné dans la section Résultats.
RÉSULTATS
Imagerie par résonance magnétique fonctionnelle
Analyses sur un seul sujet
Des voxels sensibles à l'alphabétisation ont été identifiés dans le
dlPFC dans 11 matières et dans le SPL en tout 12 sujets.
Des voxels sensibles à la charge ont été identifiés dans 11 sujets, dans le
régions suivantes (avec n correspondant au nombre
des sujets chez lesquels il a été détecté):
supérieur gauche
gyrus temporal et/ou lobule pariétal inférieur, n = 5;
lobule pariétal inférieur droit, n = 1; SPL, n = 2; dorsale gauche
cortex extrastrié, n = 1; sulcus central gauche, n = 2; droite
sillon central, n = 1; gyrus cingulaire antérieur, n = 1; gauche
dlPFC, n = 2; pôle temporal droit, n = 1. Pour accueillir-
dater cette variabilité topographique, la « sensibilité à la charge
région » a été définie exclusivement à partir du propre fonctionnel-
liens et autorisés à varier topographiquement à travers les sous-marins-
projets. Pour répondre à la question de savoir si l'alphabétisation
la sensibilité et la sensibilité de charge sont vues dans le même vox-
le, nous avons extrait des estimations de ces deux effets (voir
Rubrique Méthodes, Imagerie par résonance magnétique fonctionnelle-
ing, Analyses) à partir de voxels sensibles à l'alphabétisation trouvés
dans les trois ROI (sensible à la charge, dlPFC, et SPL) aussi
à partir des voxels sensibles à la charge trouvés dans ces ROI (par exemple.,
1716
Journal des neurosciences cognitives
Volume 18, Nombre 10
D
o
w
n
je
o
un
d
e
d
F
r
o
m
je
je
/
/
/
/
/
j
F
/
t
t
je
t
.
:
/
/
D
h
t
o
t
w
p
n
:
o
/
un
/
d
m
e
je
d
t
F
p
r
o
r
m
c
.
h
s
je
p
je
v
d
e
je
r
r
e
c
c
h
t
.
un
m
je
r
e
.
d
c
u
o
m
o
/
c
j
n
o
un
c
r
n
t
je
c
/
un
e
r
–
p
t
d
je
c
1
je
8
e
1
–
0
p
1
d
7
F
1
/
2
1
8
1
/
9
1
3
5
0
6
/
0
1
3
7
1
o
2
c
/
n
1
2
7
0
5
0
5
6
9
1
4
8
8
/
1
j
0
o
1
c
7
n
1
.
2
2
p
0
d
0
6
b
.
oui
1
g
8
u
.
e
1
s
0
t
.
o
1
n
7
0
1
7
2
S
.
e
p
p
d
F
e
m
b
b
oui
e
r
g
2
u
0
e
2
s
3
t
/
j
t
.
.
.
F
.
.
o
n
1
8
M.
un
oui
2
0
2
1
à partir de voxels sensibles à l'alphabétisation dans le dlPFC, nous
extrait une estimation de la sensibilité de l'alphabétisation
et de la sensibilité à la charge.) Contrôle de l'effet moyen
tailles et leurs associées 95% intervalles de confiance indi-
a indiqué que dans aucun des ROI, l'alphabétisation n'était effectuée-
les voxels sensibles affichent une sensibilité de charge significative ou, dans
n'importe quel retour sur investissement, les voxels sensibles à la charge ont-ils démontré l'alphabet-
sensibilité de isation (Chiffre 1). En effet, dans le dlPFC et
SPL, Les voxels sensibles à l'alphabétisation ont montré un négatif fiable-
effets de charge atifs (méchant et 95% Intervalle de confiance <
0). These results replicate and extend the findings of
Postle et al. (1999) and stand in contrast to the conclu-
sions of Veltman et al. (2003).
Group Analyses
Alphabetization-sensitive activity identified by the spatial
normalization-based group analyses was extensive and
spanned large extents, bilaterally, of the PFC, anterior
cingulate cortex, superior frontal cortex, SPL, and the
caudate nucleus (Table 1). In both hemispheres of the
PFC, these voxels showed a significant negative effect of
load [right: t(11) = (cid:3)3.4, p < .01; left: t(11) = (cid:3)4.4,
p < .005]. Load-sensitive activity identified by this analy-
sis was markedly more sparse, consisting only of indi-
vidual voxels in the right and left frontal cortex, right
central sulcus and parietal cortex, and three locations in
the right temporal lobe (Table 1). In neither hemisphere
of the PFC did these load-sensitive voxels show a sig-
nificant alphabetization effect [right: t(11) = (cid:3)0.5, ns;
left: t(11) = 1.5, ns]. Therefore, the results of the group
analyses also demonstrated a dissociation of retention
from manipulation effects (as with the single-subject
analyses, consistent with Postle et al., 1999, and incon-
sistent with Veltman et al., 2003).
Repetitive Transcranial Magnetic Stimulation
rTMS was performed in the left hemisphere in seven
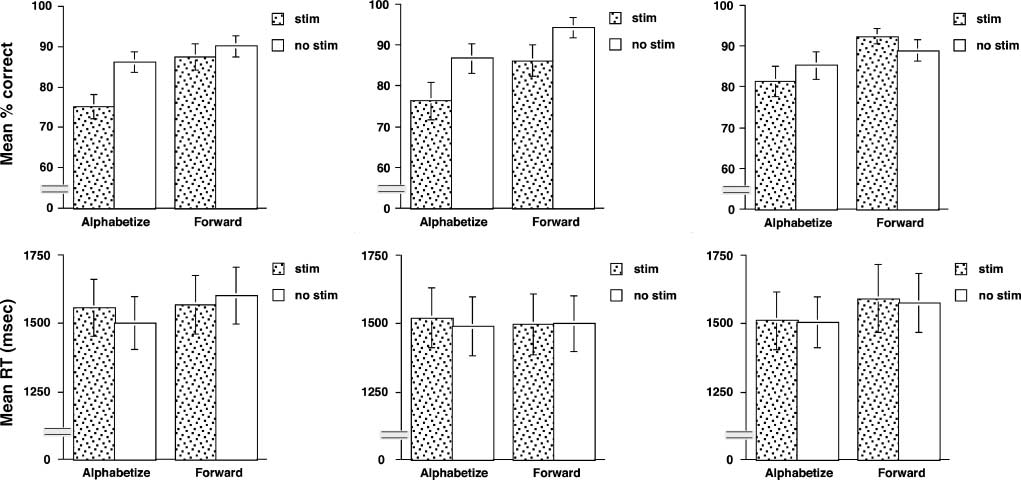
subjects and in the right hemisphere in five (Figure 2).
Analyses of variance (ANOVAs) indicated that rTMS had
its greatest effects on Alphabetize 5 performance at the
dlPFC and SPL sites and on Forward 5 performance at
the SPL (Figure 3). An initial omnibus ANOVA found no
effect of hemisphere of stimulation, F(1,10) = 0.1, ns,
and so all subsequent analyses collapsed across this varia-
ble. Omnibus ANOVA of the accuracy data revealed main
effects of trial type, F(1,11) = 11.2, p < .005, and rTMS,
F(1,11) = 7.6, p < .05, but not of region, F(2,22) < 1.0,
ns, interactions Region (cid:1) rTMS, F(2,22) = 4.9, p < .05,
and Trial Type (cid:1) rTMS, F(1,11) = 5.42, p < .05 (no other
interactions achieved significance, Fs < 1.0). ANOVA of
the accuracy data from dlPFC alone confirmed a selective
effect of rTMS on alphabetization performance, with sig-
nificant main effects of trial type, F(1,11) = 10.4, p < .01,
and rTMS, F(1,11) = 9.5, p < .05, and a Trial type (cid:1) rTMS
interaction, F(1,11) = 5.1, p < .05. In contrast, ANOVA of
the accuracy data from the PCG control region did not
show evidence for comparable selectivity of rTMS. In-
stead, it revealed a main effect of trial type, F(1,11) = 5.7,
p < .05, but no main effect of rTMS or Trial type (cid:1) rTMS
interaction (Fs < 3.5). To confirm the differential effects
of rTMS on these two regions, ANOVA directly comparing
the dlPFC with PCG was performed. It revealed a main
effect of trial type, F(1,11) = 10.6, p < .001, Region (cid:1)
rTMS interaction, F(1,11) = 7.1, p < .05, and Trial Type (cid:1)
rTMS interaction, F(1,11) = 9.3, p < .05.
In contrast with the results from the dlPFC, ANOVA of
the accuracy data from SPL stimulation revealed main
effects of trial type, F(1,11) = 5.1, p < .05, and rTMS,
F(1,11) = 5.1, p < .05, but no Trial Type (cid:1) rTMS
interaction, F(1,11) < 1, ns. The absence of this inter-
action indicated that rTMS effects on Alphabetize 5 and
Forward 5 performance were comparable.
Analyses of RT data (Figure 3) confirmed that there
were no effects of interest in these data (including no
effect of hemisphere of stimulation; Fs (cid:4) 2.0, ns). Note
that the mean RT, collapsed across all trial types and
regions, was roughly double that of the 800-msec intru-
sion of rTMS, experienced by nine of the subjects, into
the probe epoch of the trial. This, and the fact that in no
region was RT sensitive to rTMS, gives us confidence
that the error effects reported above were because of
the disruption of processes engaged during the delay
period.
DISCUSSION
The results from the dlPFC are clear: Alphabetization-
related fMRI activity is independent of (indeed, perhaps
negatively correlated with) load-related activity, and
delay-period rTMS of
loci of alphabetization-related
activity produces a decrement on Alphabetize 5 trials,
but not on Forward 5 trials. This portion of the results
therefore confirms our hypothesis that disruption
of manipulation-sensitive regions of the dlPFC would
disrupt manipulation-dependent, but not retention-
dependent, performance. (Note that these dlPFC results
cannot be attributed to the disparity in difficulty be-
tween the two tasks because of the results from the
SPL.) Our preferred interpretation of this aspect of our
results is that they were produced by rTMS disruption
of delay-period manipulation processes. We cannot rule
out, however, the possibility that the spillover of rTMS
into the first 300–800 msec of the probe epoch may
have interfered with probe perception and/or evaluation-
related processes. Nonetheless, this ambiguity does not
lessen the result of principle theoretical import, which
is that rTMS manipulation-sensitive regions of the dlPFC
did not significantly disrupt the STR of information.
The results from the SPL are more complex and,
indeed, illustrate the value that disruptive techniques
Postle et al.
1717
D
o
w
n
l
o
a
d
e
d
f
r
o
m
l
l
/
/
/
/
/
j
f
/
t
t
i
t
.
:
/
/
D
h
t
o
t
w
p
n
:
o
/
a
/
d
m
e
i
d
t
f
p
r
o
r
m
c
.
h
s
i
p
l
v
d
e
i
r
r
e
c
c
h
t
.
a
m
i
r
e
.
d
c
u
o
m
o
/
c
j
n
o
a
c
r
n
t
i
c
/
a
e
r
-
p
t
d
i
c
1
l
8
e
1
-
0
p
1
d
7
f
1
/
2
1
8
1
/
9
1
3
5
0
6
/
0
1
3
7
1
o
2
c
/
n
1
2
7
0
5
0
5
6
9
1
4
8
8
/
1
j
0
o
1
c
7
n
1
.
2
2
p
0
d
0
6
b
.
y
1
g
8
u
.
e
1
s
0
t
.
o
1
n
7
0
1
7
2
S
.
e
p
p
d
f
e
m
b
b
y
e
r
g
2
u
0
e
2
s
3
t
/
j
t
.
.
.
.
.
f
o
n
1
8
M
a
y
2
0
2
1
D
o
w
n
l
o
a
d
e
d
f
r
o
m
l
l
/
/
/
/
/
j
f
/
t
t
i
t
.
:
/
/
D
h
t
o
t
w
p
n
:
o
/
a
/
d
m
e
i
d
t
f
p
r
o
r
m
c
.
h
s
i
p
l
v
d
e
i
r
r
e
c
c
h
t
.
a
m
i
r
e
.
d
c
u
o
m
o
/
c
j
n
o
a
c
r
n
t
i
c
/
a
e
r
-
p
t
d
i
c
1
l
8
e
1
-
0
p
1
d
7
f
1
/
2
1
8
1
/
9
1
3
5
0
6
/
0
1
3
7
1
o
2
c
/
n
1
2
7
0
5
0
5
6
9
1
4
8
8
/
1
j
0
o
1
c
7
n
1
.
2
2
p
0
d
0
6
b
.
y
1
g
8
u
.
e
1
s
0
t
.
o
1
n
7
0
1
7
2
S
.
e
p
p
d
f
e
m
b
b
y
e
r
g
2
u
0
e
2
s
3
t
/
j
t
.
f
.
.
.
.
o
n
1
8
M
a
y
2
0
2
1
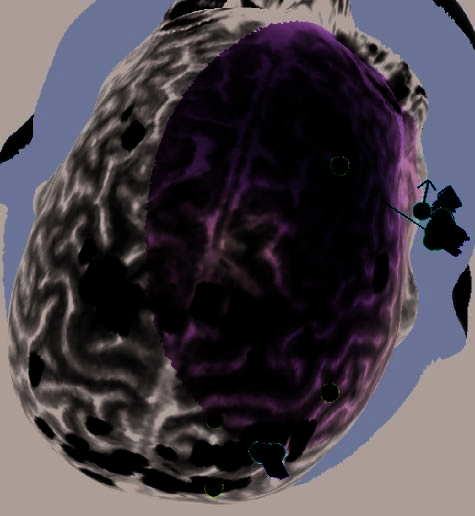
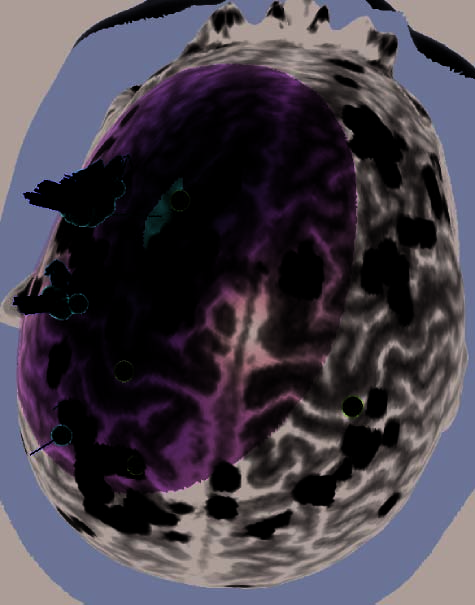
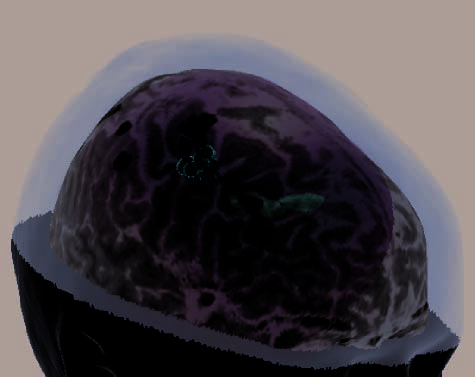
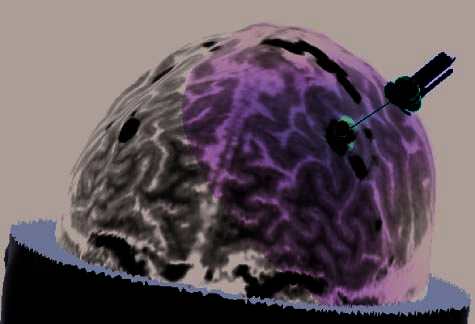
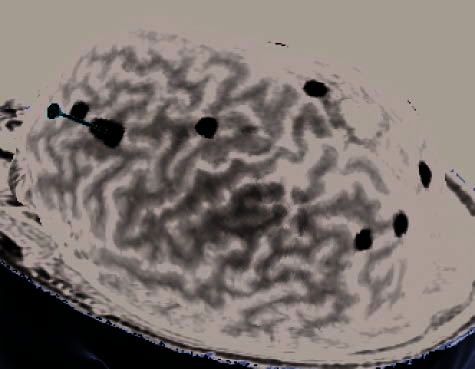
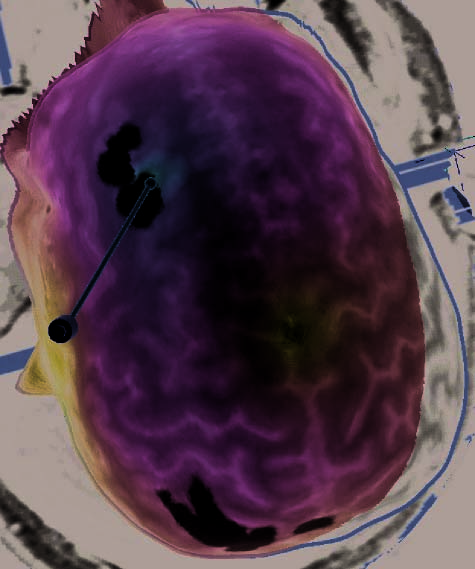
Figure 2. (A) Illustration of an rTMS experiment, from Subject 14 as displayed by the NBS system. The brain is displayed as though looking down
from above, with the nose at the top of the image. The right hemisphere appears on the right side of the image. Skin and bone have been removed
to below the level of the Sylvian fissure, and the cortex has been ‘‘peeled’’ to the depth that best displays the fMRI information (white blobs
indicate regions showing alphabetization sensitivity). Each red sphere indicates the location on the scalp at which an rTMS train was delivered; the
corresponding yellow spike indicates the orientation of the induced magnetic field for that stimulation train; the corresponding orange arrow indicates
the estimated direction of current induction. Purple spheres indicate the targeted portions of the dlPFC and SPL. For this subject, PCG was the last
region stimulated, and the splash of purple color at the end of the red spike indicates the estimated area of maximal intensity of the single rTMS
train that is captured in this image. (B–H) Analogous images, highlighting rTMS of the dlPFC, are presented for seven additional subjects. Images for
the rTMS sessions of the remaining four subjects were lost during a software upgrade. (B) Illustration of the left dlPFC rTMS of Subject 3. Display
conventions are the same as those in (A). (C) Illustration of the right dlPFC rTMS of Subject 8. Display conventions are the same as those in (A).
(D) Illustration of the three rTMS targets of Subject 16, including the left dlPFC. Display conventions are the same as those in (A).
1718
Journal of Cognitive Neuroscience
Volume 18, Number 10
D
o
w
n
l
o
a
d
e
d
f
r
o
m
l
l
/
/
/
/
/
j
f
/
t
t
i
t
.
:
/
/
D
h
t
o
t
w
p
n
:
o
/
a
/
d
m
e
i
d
t
f
p
r
o
r
m
c
.
h
s
i
p
l
v
d
e
i
r
r
e
c
c
h
t
.
a
m
i
r
e
.
d
c
u
o
m
o
/
c
j
n
o
a
c
r
n
t
i
c
/
a
e
r
-
p
t
d
i
c
1
l
8
e
1
-
0
p
1
d
7
f
1
/
2
1
8
1
/
9
1
3
5
0
6
/
0
1
3
7
1
o
2
c
/
n
1
2
7
0
5
0
5
6
9
1
4
8
8
/
1
j
0
o
1
c
7
n
1
.
2
2
p
0
d
0
6
b
.
y
1
g
8
u
.
e
1
s
0
t
.
o
1
n
7
0
1
7
2
S
.
e
p
p
d
f
e
m
b
b
y
e
r
g
2
u
0
e
2
s
3
t
/
j
t
.
f
.
.
.
.
o
n
1
8
M
a
y
2
0
2
1
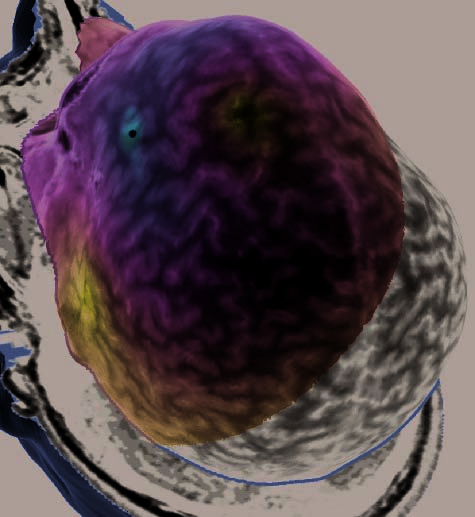
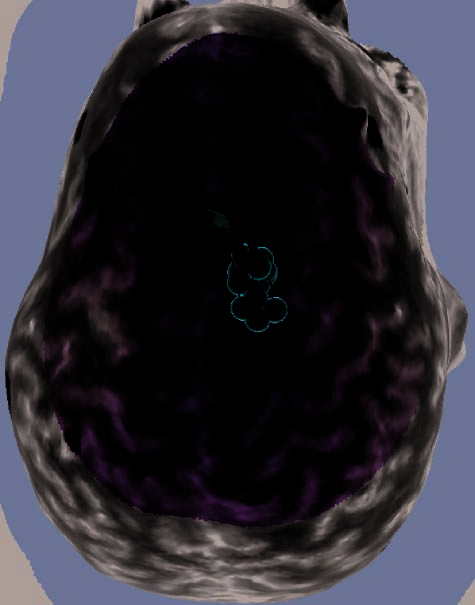
Figure 2. (continued ) (E) Illustration of frontal-lobe rTMS target of Subject 20. This is the subject mentioned in footnote 3, who could
not tolerate MFG rTMS. Display conventions are the same as those in (A). (F ) Illustration of the left dlPFC rTMS of Subject 25. Display
conventions differ from those in (A) in that an orange sphere represents the targeted portion of cortex and information relating to the NBS
system’s estimates of stimulation parameters is not shown. (G) Illustration of the left dlPFC rTMS of Subject 27. Display conventions are
the same as those in (F), except that the line emanating from the targeted portion of cortex illustrates the maximal energy vector of the
rTMS-induced magnetic field. (H) Illustration of the left dlPFC rTMS of Subject 17. Display conventions are the same as those in (G).
Postle et al.
1719
D
o
w
n
l
o
a
d
e
d
f
r
o
m
l
l
/
/
/
/
/
j
f
/
t
t
i
t
.
:
/
/
D
h
t
o
t
w
p
n
:
o
/
a
/
d
m
e
i
d
t
f
p
r
o
r
m
c
.
h
s
i
p
l
v
d
e
i
r
r
e
c
c
h
t
.
a
m
i
r
e
.
d
c
u
o
m
o
/
c
j
n
o
a
c
r
n
t
i
c
/
a
e
r
-
p
t
d
i
c
1
l
8
e
1
-
0
p
1
d
7
f
1
/
2
1
8
1
/
9
1
3
5
0
6
/
0
1
3
7
1
o
2
c
/
n
1
2
7
0
5
0
5
6
9
1
4
8
8
/
1
j
0
o
1
c
7
n
1
.
2
2
p
0
d
0
6
b
.
y
1
g
8
u
.
e
1
s
0
t
.
o
1
n
7
0
1
7
2
S
.
e
p
p
d
f
e
m
b
b
y
e
r
g
2
u
0
e
2
s
3
t
/
j
t
.
.
.
.
.
f
o
n
1
8
M
a
y
2
0
2
1
Figure 3. Results from rTMS session. Error bars indicate SEM.
can bring to systems-level analyses of cognitive func-
tions. As with the dlPFC,
fMRI data from the SPL
indicated that alphabetization-related activity was inde-
pendent of retention-related activity in the SPL. The
rTMS data, however,
led to the opposite conclusion:
Disruption of activity at alphabetization-sensitive sites in
the SPL yielded comparable levels of impairment on
retention-requiring trials as on manipulation-requiring
trials. There are at least two possible explanations for
this divergence of the rTMS from the fMRI data. One is
that the fMRI techniques that we employed are not
sufficiently sensitive to detect retention-related effects
in the SPL that are nonetheless sensitive to rTMS, a
possibility that would suggest that manipulation- and
retention-related functions are not independent in the
SPL. This is difficult to reconcile, however, with the fact
that the SPL load effects in alphabetization-sensitive
voxels were not simply ‘‘not different from 0,’’ but were
actually significantly less than 0. A second explanation,
is that the SPL voxels identified by
which we favor,
fMRI as alphabetization-specific are just that, but that
the SPL sites that we stimulated were more proximal
to retention-related areas than were the analogous
dlPFC sites. The proximity invoked here might be either
topographical or synaptic. By the former account, the
spread of the rTMS-induced electric field might be
such that rTMS targeting the SPL also has disruptive
effects on topographically adjacent areas, such as the
angular and/or supramarginal gyri of the inferior parietal
lobule, that may, themselves, support the retention of
phonologically encoded information in working mem-
ory. By the latter account, the region(s) supporting
retention may be only one or two synapses distant from
the SPL. It is known, for example, that TMS produces
PET activation in regions that are mono- and disynapti-
cally connected to the region that is directly targeted
with TMS (Ferrarelli et al., 2004).
The absence of disruptive effects of the PFC rTMS
on Forward 5 performance is consistent with the previ-
ously existing literature. Most notably, Herwig et al.
(2003) used a delayed letter recognition task quite sim-
ilar to our Forward 5 trials, and a similar method for
guiding rTMS with fMRI data. They found no effect with
a memory load of six items of delay-period rTMS target-
ing the dlPFC or parietal cortex (SPL or inferior parietal
lobule, depending on the subject). With a load of seven
items, however, delay-period rTMS targeting both the lat-
eral premotor and parietal cortex and had disruptive ef-
fects. (They did not stimulate the dlPFC at load 7.) Other
studies that have disrupted working memory perform-
ance with rTMS of the PFC have used tasks that leave
ambiguous the type of information and/or process that is
being disrupted. For example, delay-period activity during
spatial delayed response (Brandt, Ploner, Meyer, Leistner,
& Villringer, 1998; Pascual-Leone & Hallett, 1994) might
be sensory, attentional, motoric, or some combination of
these. The n-back task (Mottaghy, Gangitano, Krause, &
Pascual-Leone, 2003; Mottaghy, Doring, Muller-Gartner,
Topper, & Krause, 2002; Mottaghy et al., 2000) requires
the simultaneous engagement of several retention- and
control-related operations. The absence of laterality effect
in our rTMS results is also consistent with the existing
literature, which documents disruption of verbal working
memory performance with right hemisphere as well as
left hemisphere rTMS (e.g., Herwig et al., 2003; Mottaghy
et al., 2002). This may be because of the complex and
1720
Journal of Cognitive Neuroscience
Volume 18, Number 10
distributed nature of the networks that support verbal
working memory (e.g., Mottaghy et al., 2002, 2003) and/
or that rTMS of a right hemisphere target is expected to
have strong effects on the homologous contralateral re-
gion (Ferrarelli et al., 2004; Bestmann, Baudewig, Siebner,
Rothwell, & Frahm, 2003).
The results of the present study are consistent with a
model of segregation of executive control from STR
functions in the PFC. They are also consistent with the
idea that posterior regions may be more important for
the STR of information than is the PFC. The contribu-
tions of the PFC to working memory may be via general-
purpose control processes that are not specialized for
working memory (Postle, in press).
Acknowledgments
We thank Steve Esser, Olufunsho Faseyitan, Cassandra Jones,
and Christopher Jordan for technical and experimental assist-
ance. This work was supported by NIH MH064498 (B. R. P.)
and NARSAD (G. T.).
Reprints requests should be sent to Bradley R. Postle, 1202
West Johnson Street, Madison, WI 53726, USA, or via e-mail:
postle@wisc.edu.
Notes
1. The logic of this portion of the study was that Forward 2
trials had only been included in the fMRI study to permit eval-
uation of whether alphabetization-sensitive voxels (i.e., voxels
significant for the [DelayAlphabetize 5–DelayForward 5] contrast)
also showed load sensitivity (as assessed with the contrast
[DelayForward 5–DelayForward 2]). For rTMS, however, Forward 5
trials were sufficient, because if Forward 5 performance were
disrupted by delay-period rTMS, one could infer that processes
necessary for the STR of 5 items were disrupted. (Note that this
inference would hold whether or not Forward 2 performance
was disrupted by rTMS, a fact that makes clear why Forward 2
trials were not needed for the rTMS portion of this study.)
The converse would be true if Forward 5 performance were
not disrupted by delay-period rTMS.
2. The motor threshold offers a means of normalizing stim-
ulation intensity across subjects, because stimulation of the
(contralateral) motor cortex and PFC at motor threshold pro-
duces positively correlated evoked responses (Kahkonen et al.,
2004).
3. One subject (Subject 20) could not tolerate rTMS of the
MFG, because of excessive stimulation of the superior auricularis
muscle. For this subject, a cluster of alphabetization-sensitive
voxels along the midline, in a region judged to correspond to
Brodmann’s area 8, was selected as the alternative target for
dlPFC stimulation (Figure 2E). The remaining two regions for
this subject were stimulated in the right hemisphere.
REFERENCES
Aguirre, G. K., Zarahn, E., & D’Esposito, M. (1998). The
variability of human, BOLD hemodynamic responses.
Neuroimage, 8, 360–369.
Baddeley, A. D. (2000). The episodic buffer: A new component of
working memory? Trends in Cognitive Sciences, 4, 417–423.
Baddeley, A. D., & Logie, R. H. (1999). Working memory:
The multiple-component model. In A. Miyake & P. Shah
(Eds.), Models of working memory (pp. 28–61). Cambridge,
UK: Cambridge University Press.
Bestmann, S., Baudewig, J., Siebner, H. R., Rothwell, J. C.,
& Frahm, J. (2003). Subthreshold high-frequency TMS of
human primary motor cortex modulates interconnected
frontal motor areas as detected by interleaved fMRI-TMS.
Neuroimage, 20, 1685–1696.
Boynton, G. M., Engel, S. A., Glover, G. H., & Heeger, D. J.
(1996). Linear systems analysis of functional magnetic
resonance imaging in human V1. Journal of Neuroscience,
16, 4207–4221.
Brandt, S. A., Ploner, C. J., Meyer, B.-U., Leistner, S., &
Villringer, A. (1998). Effects of repetitive transcranial
magnetic stimulation over dorsolateral prefrontal and
posterior parietal cortex on memory-guided saccades.
Experimental Brain Research, 118, 197–204.
Constantinides, C., Franowicz, M. N., & Goldman-Rakic, P. S.
(2001). The sensory nature of mnemonic representation
in the primate prefrontal cortex. Nature Neuroscience, 4,
311–316.
Courtney, S. M. (2004). Attention and cognitive control as
emergent properties of information representation in
working memory. Cognitive, Affective, & Behavioral
Neuroscience, 4, 501–516.
D’Esposito, M., & Postle, B. R. (1999). The dependence of
span and delayed-response performance on prefrontal
cortex. Neuropsychologia, 37, 1303–1315.
Feredoes, E., & Postle, B. R. (2005). Does size matter?
Quantitatively and qualitatively discrepant results
yielded by single-subject and spatial normalization
approaches to fMRI group analysis. Poster presented at
the annual meeting of the Society for Neuroscience 2005.
Ferrarelli, F., Haraldsson, H. M., Barnhart, T. E., Roberts,
A. D. F., Oakes, T. R., Massimini, M., Stone, C. K., Kalin,
N. H., & Tononi, G. (2004). A [17F]-fluoromethane PET/TMS
study of effective connectivity. Brain Research Bulletin,
64, 103–113.
Friston, K. J., Holmes, A. P., Poline, J.-B., Heather, J. D., &
Frackowiak, R. S. J. (1995). Analysis of fMRI time-series
revisited. Neuroimage, 2, 45–53.
Funahashi, S., Chafee, M. V., & Goldman-Rakic, P. S. (1993).
Prefrontal neuronal activity in rhesus monkeys performing
a delayed anti-saccade task. Nature, 365, 753–756.
Garavan, H., Ross, T. J., Li, S.-J., & Stein, E. A. (2000). A
parametric manipulation of central executive functioning.
Cerebral Cortex, 10, 585–592.
Goldman-Rakic, P. S., & Leung, H.-C. (2002). Functional
architecture of the dorsolateral prefrontal cortex in
monkeys and humans. In D. T. Stuss & R. T. Knight (Eds.),
Principles of frontal lobe function (pp. 85–95). Oxford:
Oxford University Press.
Hamilton, M. (1960). A rating scale for depression. Journal
of Neurology, Neurosurgery, and Psychiatry, 23, 56–62.
Handwerker, D. A., Ollinger, J. M., & D’Esposito, M. (2004).
Variation of BOLD hemodynamic responses across subjects
and brain regions and their effects on statistical analyses.
Neuroimage, 21, 1639–1651.
Herwig, U., Abler, B., Schonfeldt-Lecuona, C., Wunderlich, A.,
Grothe, J., Spitzer, M., & Walter, H. (2003). Verbal storage
in a premotor-parietal network: Evidence from fMRI-guided
magnetic stimulation. Neuroimage, 20, 1032–1041.
Jonides, J., Lacey, S. C., & Nee, D. E. (2005). Processes of
working memory in mind and brain. Current Directions
in Psychological Science, 14, 2–5.
Josephs, O., Turner, R., & Friston, K. (1997). Event-related
fMRI. Human Brain Mapping, 5, 243–248.
Postle et al.
1721
D
o
w
n
l
o
a
d
e
d
f
r
o
m
l
l
/
/
/
/
/
j
f
/
t
t
i
t
.
:
/
/
D
h
t
o
t
w
p
n
:
o
/
a
/
d
m
e
i
d
t
f
p
r
o
r
m
c
.
h
s
i
p
l
v
d
e
i
r
r
e
c
c
h
t
.
a
m
i
r
e
.
d
c
u
o
m
o
/
c
j
n
o
a
c
r
n
t
i
c
/
a
e
r
-
p
t
d
i
c
1
l
8
e
1
-
0
p
1
d
7
f
1
/
2
1
8
1
/
9
1
3
5
0
6
/
0
1
3
7
1
o
2
c
/
n
1
2
7
0
5
0
5
6
9
1
4
8
8
/
1
j
0
o
1
c
7
n
1
.
2
2
p
0
d
0
6
b
.
y
1
g
8
u
.
e
1
s
0
t
.
o
1
n
7
0
1
7
2
S
.
e
p
p
d
f
e
m
b
b
y
e
r
g
2
u
0
e
2
s
3
t
/
j
t
.
.
.
.
.
f
o
n
1
8
M
a
y
2
0
2
1
Kahkonen, S., Wilenius, J., Komssi, S., & Elmoniemi, R. J.
Pessoa, L., Gutierrez, E., Bandettini, P. A., & Ungerleider,
(2004). Distinct differences in cortical reactivity of motor
and prefrontal cortices to magnetic stimulation. Clinical
Neurophysiology, 115, 583–588.
Kwong, K. K., Belliveau, J. W., Chesler, D. A., Goldberg, I. E.,
Weisskoff, R. M., Poncelet, B. P., Kennedy, D. N., Hoppel,
B. E., Cohen, M. S., Turner, R., Cheng, H. M., Bradly, T. J.,
& Rosen, B. R. (1992). Dynamic magnetic resonance
imaging of human brain activity during primary sensory
stimulation. Proceedings of the National Academy of
Sciences, U.S.A., 89, 5675–5679.
Lebedev, M. A., Messinger, A., Kralik, J. D., & Wise, S. P.
(2004). Representation of attended versus remembered
locations in prefrontal cortex. PloS Biology, 2, 1919–1935.
Leung, H.-C., Seelig, D., & Gore, J. C. (2004). The effect of
memory load on cortical activity in the spatial working
memory circuit. Cognitive, Affective, & Behavioral
Neuroscience, 4, 553–563.
Miller, M. B., Van Horn, J. D., Wolford, G. L., Handy, T. C.,
Valsangkar-Smyth, M., Inati, S., Grafton, S., & Gazzaniga,
M. S. (2002). Extensive individual differences in brain
activations associated with episodic retrieval are reliable over
time. Journal of Cognitive Neuroscience, 14, 1200–1214.
Mottaghy, F. M., Doring, T., Muller-Gartner, H. W., Topper, R.,
& Krause, B. J. (2002). Bilateral parietofrontal network for
verbal working memory: An interference approach using
repetitive transcranial magnetic stimulation. European
Journal of Neuroscience, 16, 1627–1632.
Mottaghy, F. M., Gangitano, M., Krause, B. J., & Pascual-Leone, A.
(2003). Chronometry of parietal and prefrontal activations
in verbal working memory revealed by transcranial
magnetic stimulation. Neuroimage, 18, 565–575.
Mottaghy, F. M., Krause, B. J., Kemna, L. J., Topper, R.,
Tellmann, L., Beu, M., Pascual-Leone, A., & Muller-Gartner,
H. W. (2000). Modulation of the neuronal circuitry
subserving working memory in healthy human subjects by
repetitive transcranial magnetic stimulation. Neuroscience
Letters, 280, 167–170.
Narayanan, N., Prabhakaran, V., Bunge, S. A., Christoff, K.,
Fine, E. M., & Gabrieli, J. D. (2005). The role of prefrontal
cortex in the maintenance of verbal working memory
information: An event-related fMRI analysis.
Neuropsychology, 19, 223–232.
Ogawa, S., Tank, D. W., Menon, R., Ellermann, J. M., Kim, S. G.,
Merkle, H., & Ugurbil, K. (1992). Intrinsic signal changes
accompanying sensory stimulation: Functional brain
mapping using MRI. Proceedings of the National Academy
of Sciences, U.S.A., 89, 5951–5955.
Pascual-Leone, A., & Hallett, M. (1994). Induction of errors
in a delayed response task by repetitive transcranial
magnetic stimulation of the dorsolateral prefrontal
cortex. NeuroReport, 5, 2517–2520.
L. G. (2002). Neural correlates of visual working memory:
fMRI amplitude predicts task performance. Neuron, 35,
975–987.
Petrides, M. (2000). Dissociable roles of mid-dorsolateral
prefrontal and anterior inferotemporal cortex in
visual working memory. Journal of Neuroscience, 20,
7496–7503.
Postle, B. R. (2006). Working memory as an emergent property
of the mind and brain. Neuroscience, 139, 23–38.
Postle, B. R., Berger, J. S., & D’Esposito, M. (1999). Functional
neuroanatomical double dissociation of mnemonic and
executive control processes contributing to working
memory performance. Proceedings of the National
Academy of Sciences, U.S.A., 96, 12959–12964.
Postle, B. R., Zarahn, E., & D’Esposito, M. (2000). Using
event-related fMRI to assess delay-period activity during
performance of spatial and nonspatial working memory
tasks. Brain Research Protocols, 5, 57–66.
Rypma, B., & D’Esposito, M. (1999). The roles of prefrontal
brain regions in components of working memory: Effects
of memory load and individual differences. Proceedings of
the National Academy of Sciences, U.S.A., 96, 6558–6563.
Sheehan, D. V., Lecrubier, Y., Sheehan, K. H., Amorim, P.,
Janavs, J., Weiller, E., Hergueta, T., Baker, R., & Dunbar, G. C.
(1998). The Mini-International Neuropsychiatric Interview
(MINI): The development and validation of a structured
diagnostic psychiatric interview for DSM-IV and ICD-10.
Journal of Clinical Psychiatry, 59, 22–33.
Swallow, K. M., Braver, T. S., Snyder, A. Z., Speer, N. K., &
Zacks, J. M. (2003). Reliability of functional localization
using fMRI. Neuroimage, 20, 1561–1577.
Talairach, J., & Tournoux, P. (1988). Co-planar stereotaxic
atlas of the human brain. New York: Thieme.
Theeuwes, J., Olivers, C. N. L., & Chizk, C. L. (2005).
Remembering a location makes the eyes curve away.
Psychological Science, 16, 196–199.
Thielscher, A., & Kammer, T. (2002). Linking physics with
physiology in TMS: A sphere field model to determine
the cortical stimulation site in TMS. Neuroimage, 17,
1117–1130.
Tsao, D. Y., Freiwald, W. A., Knutsen, T. A., Mandeville, J. B.,
& Tootell, R. B. H. (2003). Faces and objects in macaque
cerebral cortex. Nature Neuroscience, 6, 989–995.
Veltman, D. J., Rombouts, S. A., & Dolan, R. J. (2003).
Maintenance versus manipulation in verbal working memory
revisited: An fMRI study. Neuroimage, 18, 247–256.
Walsh, V., & Pascual-Leone, A. (2003). Transcranial magnetic
stimulation: A neurochronometrics of mind. Cambridge:
MIT Press.
Worsley, K. J., & Friston, K. J. (1995). Analysis of fMRI
time-series revisited—again. Neuroimage, 2, 173–182.
D
o
w
n
l
o
a
d
e
d
f
r
o
m
l
l
/
/
/
/
/
j
f
/
t
t
i
t
.
:
/
/
D
h
t
o
t
w
p
n
:
o
/
a
/
d
m
e
i
d
t
f
p
r
o
r
m
c
.
h
s
i
p
l
v
d
e
i
r
r
e
c
c
h
t
.
a
m
i
r
e
.
d
c
u
o
m
o
/
c
j
n
o
a
c
r
n
t
i
c
/
a
e
r
-
p
t
d
i
c
1
l
8
e
1
-
0
p
1
d
7
f
1
/
2
1
8
1
/
9
1
3
5
0
6
/
0
1
3
7
1
o
2
c
/
n
1
2
7
0
5
0
5
6
9
1
4
8
8
/
1
j
0
o
1
c
7
n
1
.
2
2
p
0
d
0
6
b
.
y
1
g
8
u
.
e
1
s
0
t
.
o
1
n
7
0
1
7
2
S
.
e
p
p
d
f
e
m
b
b
y
e
r
g
2
u
0
e
2
s
3
t
/
j
t
.
.
f
.
.
.
Pasternak, T., & Greenlee, M. W. (2005). Working memory
Zarahn, E., Aguirre, G. K., & D’Esposito, M. (1997). A trial-based
in primate sensory systems. Nature Reviews Neuroscience,
6, 97–107.
Peelen, M. V., & Downing, P. E. (2005). Within-subject
reproducibility of category-specific visual activation with
functional MRI. Human Brain Mapping, 25, 402–408.
experimental design for fMRI. Neuroimage, 6, 122–138.
Zarahn, E., Rakitin, B., Abela, D., Flynn, J., & Stern, Y. (2005).
Positive evidence against human hippocampal involvement
in working memory maintenance of familiar stimuli.
Cerebral Cortex, 15, 303–316.
o
n
1
8
M
a
y
2
0
2
1
1722
Journal of Cognitive Neuroscience
Volume 18, Number 10